O sulfato de bário é um sal de grande importância na indústria farmacêutica. Ele é utilizado como contraste em radiografias do sistema digestório, permitindo que o intestino apareça no exame radiográfico, visto que esse sal absorve os Raios-X.
Fonte: PERUZZO, Francisco M.; CANTO, Eduardo L. Química na Abordagem do Cotidiano. Vol. 2. São Paulo: Moderna, 2009. p.438. (adaptado)
O sulfato de bário é industrialmente produzido por meio da reação a seguir, sendo o ácido adicionado em excesso para garantir a conversão total para o sal não toxico (sulfato de bário).
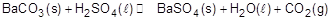
Para a produção do sal, foram misturados, no reator, 2 moles de carbonato de bário e 5 moles de ácido sulfúrico. Sabe-se que o produto de solubilidade dos sais é 8x10-8(BaCO3) e 1x10-10(BaSO4).
Afirma-se, então:
I. O sulfato de bário é menos solúvel que o carbonato de bário.
II. O volume de CO2 liberado na produção do sal, nas condições normais de pressão e temperatura (CNTP), é igual a 22,4 L.
III. A massa de ácido sulfúrico em excesso, na produção do sal, é de 294g.
Está(ão) correta(s)