A imagem abaixo representa parte de um polígono regular e um de seus ângulos internos.
A partir disso, sabemos que este polígono possui
Questões relacionadas
- Matemática
Um pacote de salgadinho preferido de uma menina é vendido em embalagens com diferentes quantidades. A cada embalagem é atribuído um número de pontos na promoção:
“Ao totalizar exatamente 12 pontos em embalagens e acrescentar mais R$ 10,00 ao valor da compra, você ganhará um bichinho de pelúcia”.
Esse salgadinho é vendido em três embalagens com as seguintes massas, pontos e preços:
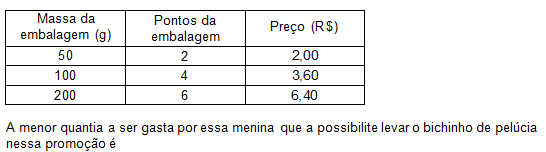
- Física
Os três blocos mostrados na figura abaixo podem deslizar sem atrito com a superfície de apoio e sem a resistência do ar. As possíveis colisões decorrentes da evolução da situação apresentada são perfeitamente elásticas

Analise as afirmativas a seguir e assinale (V) para as verdadeiras ou (F) para as falsas.
( ) Se Vb>Va o bloco C não será atingido, independentemente dos valores de Ma e Mb
( ) Se Mb<Ma o bloco C será atingido, independentemente dos valores de Va e Vb
( ) Vb=Va e Mb= Ma o bloco C será atingido, independentemente do valor de Mc
A sequência correta é:
- Língua Portuguesa - Fundamental | Não Possui Tópico Definido
HOJE É O ANIVERSÁRIO
DA MINHA AMIGA MIÚCHA.
A FESTA É À FANTASIA E
EU VOU VESTIDA DE BRUXA.
A PALAVRA VESTIDA SEPARADA EM SÍLABAS FICARÁ ASSIM
- Física | 1. Introdução à Física
Unidades
A constante universal dos gases, R, cujo valor depende das unidades de pressão, volume e temperatura, não pode ser medida em uma das unidades representadas a seguir. Assinale-a.
- Química | 2.3 Termoquímica
(UESC)
NO (g) + O. (g) → NO2(g)
Embora as variações de entalpia tenham sido medidas e organizadas em tabelas, é possível calcular a variação de entalpia de reação, ΔH, para uma reação a partir de valores de variação de entalpia tabelados. Assim, não é necessário fazer medições calorimétricas para todas as reações químicas. Dessa forma, o cálculo da variação de entalpia para a equação química que representa a reação entre o óxido de nitrogênio (II), NO (g), com o oxigênio atômico, O (g), pode ser feito com base nas variações de entalpia das equações termoquímicas
I. NO(g) + O3(g) → NO2(g) + O2(g) ΔHo = –198,9kJ
II. O3(g) → 3/2 O2(g) ΔHo = –143,3kJ
III. O2(g) → 2 O (g) ΔHo = 495,0kJ
A partir dessas considerações sobre a variação de entalpia de uma reação química, é correto afirmar: