Doors have a the shape of a
Questões relacionadas
- Matemática | 3.2 Afim ou 1° Grau
A raiz da equação x – 3(x-1) = x/3 + 2 é igual a:
- Física | 3.1 Termometria
(UESB) Temperatura é a grandeza que caracteriza o estado térmico de um corpo ou sistema e está relacionada à agitação de suas moléculas. Considere uma escala arbitrária X, cuja relação com a escala Fahrenheit é mostrada na figura.
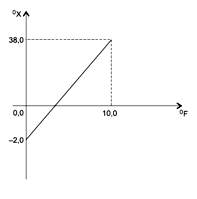
Nessas condições, a indicação na escala X, que corresponde a 12°F em °X, é igual a
- Matemática | 3.2 Afim ou 1° Grau
O consumo de água na residência de Ademar e o custo desse consumo são grandezas que se relacionam conforme mostra o gráfico.
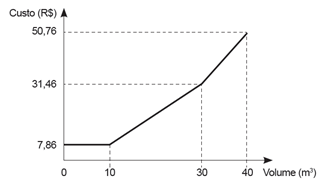
Analisando as informações contidas no gráfico, é possível concluir que
- Matemática | 8.1 Princípio Fundamental Da Contagem e Arranjo
Uma senha para operar em um determinado caixa eletrônico é formada por quatro letras e composta do seguinte modo: fixada uma ordem, a primeira letra é escolhida do conjunto {H, I, J, K, L}; a segunda letra do conjunto {X, Y, Z}; a terceira letra do conjunto {M, N, P, Q} e a quarta letra do conjunto {U, V, W}. Nestas condições o número de senhas que podem ser construidas é
- Química | 1.5 Funções Inorgânicas
TEXTO PARA A PRÓXIMA QUESTÃO:
CONSTANTES
Constante de Avogadro = 6,02 . 1023 mol-1
Constante de Faraday (F) = 9,65 . 104C mol-1 = 9,65 . 104 J V-1 mol-1
Volume molar de gás ideal = 22,4L(CNTP)
Carga elementar = 1,602 . 10-19C
Constante dos gases = 8,21 . 10-2 atm L K-1mol-1 = 1,98 cal K—1mol—1=62,4 mm Hg L K-1mol-1
Constante gravitacional (g) = 9,81 m s-2
DEFINIÇÕES
Pressão de 1 atm = 760 mmHg = 101 325 Nm-2 = 760Torr
1 J = 1 Nm = 1 kg m2s-2
Condições normais de temperatura e pressão (CNTP): 0ºC e 760 mmHg
Condições ambientes: 25ºC e 1 atm
Condições-padrão: 25ºC e 1 atm; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido; () = líquido; (g) = gás; (aq) = aquoso; (CM) = circuito metálico; (conc) = concentrado; (ua) = unidades arbitrárias; [A] = concentração da espécie química A em mol L-1
MASSAS MOLARES
Elemento
Químico
Número
Atômico
Massa Molar
(g. mol-1)
Elemento
Químico
Número
Atômico
Massa Molar
(g.mol-1)
H
1
1,01
S
16
32,07
Li
3
6,94
Cl
17
35,45
C
6
12,01
K
19
39,10
N
7
14,01
Ca
20
40,08
O
8
16,00
Mn
25
54,94
F
9
19,00
As
33
74,92
Na
11
22,99
Br
35
79,90
Mg
12
24,30
Ag
47
107,90
Al
13
26,98
I
53
126,90
Si
14
28,08
Pt
78
195,08
P
15
30,97
Hg
80
200,59
Considere as seguintes afirmações a respeito dos haletos de hidrogênio HF, HC, HBr e HI.
I. A temperatura de ebulição do HI é maior do que a dos demais.
II. À exceção do HF, os haletos de hidrogênio dissociam-se completamente em água.
III. Quando dissolvidos em ácido acético glacial puro, todos se comportam como ácidos, conforme a seguinte ordem de força ácida: Hl > HBr > HCℓ >> HF.
Das afirmações acima, está(ão) correta(s) apenas