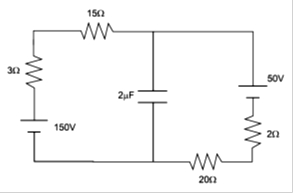
01
(UESB)
II. H2(g) + ½ O2(g) →H2O(l) ΔH2 = – 286,0 kJ/mol
III. CH4(g) + 2 O2(g) →CO2(g) + 2 H2O(l) ΔH3 = – 895,0 kJ
IV. C(grafite) + 2H2(g) →CH4(g)
A lei de Germain Henry Hess tem importância fundamental no estudo de termoquímica e estabelece que a variação da entalpia de uma reação química depende apenas dos estados inicial e final da reação. Desse modo, considerando-se as equações termoquímicas I, II e III, é possível calcular, aplicando-se a Lei de Hess, a variação de entalpia da reação química representada em IV.
Levando-se em consideração essas informações e as equações termoquímicas I, II e III, e a equação química IV, é correto afirmar: