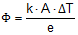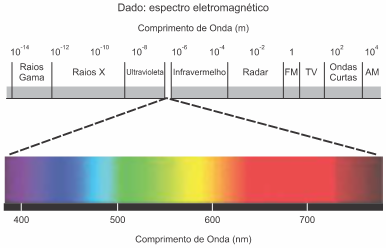
O espectro de emissão do hidrogênio apresenta uma série de linhas na região do ultravioleta, do visível e no infravermelho próximo, como ilustra a figura a seguir.
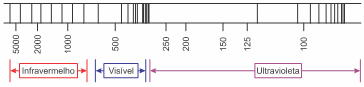
Niels Bohr, físico dinamarquês, sugeriu que o espectro de emissão do hidrogênio está relacionado às transições do elétron em determinadas camadas. Böhr calculou a energia das camadas da eletrosfera do átomo de hidrogênio, representadas no diagrama de energia a seguir. Além disso, associou as transições eletrônicas entre a camada dois e as camadas de maior energia às quatro linhas observadas na região do visível do espectro do hidrogênio.

Um aluno encontrou um resumo sobre o modelo atômico elaborado por Böhr e o espectro de emissão atômico do hidrogênio contendo algumas afirmações.
I. A emissão de um fóton de luz decorre da transição de um elétron de uma camada de maior energia para uma camada de menor energia.
II. As transições das camadas 2, 3, 4, 5 e 6 para a camada 1 correspondem às transições de maior energia e se encontram na região do infravermelho do espectro.
III. Se a transição 3 -> 2 corresponde a uma emissão de cor vermelha, a transição 4 -> 2 está associada a uma emissão violeta e a 5 -> 2 está associada a uma emissão verde.
Pode-se afirmar que está(ão) correta(s)