Aluno
Dúvida
Química - Química Geral e Inorgânica
Olá! Como eu conseguiria chegar na alternativa correta na seguinte questão?
(UEFS)
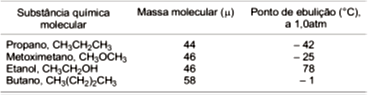
As forças das interações intermoleculares são responsáveis por manter os estados de agregação nos líquidos e nos sólidos moleculares, além de influir sobre a diferença de temperatura de ebulição entre essas substâncias. Embora a intensidade das interações intermoleculares represente um fator preponderante, o tamanho da molécula também influi sobre a temperatura de ebulição dessas substâncias.
A tabela apresenta as massas moleculares e os pontos de ebulição de algumas substâncias moleculares. A partir dessas informações e da análise desses dados da tabela, é correto afirmar:
As forças de interações intermoleculares no propano e no butano justificam a diferença entre os pontos de ebulição dessas substâncias.
Os pontos de ebulição do etanol e do metoximetano são diferentes porque as ligações de hidrogênio no metoximetano são mais fracas que no etanol.
As interações intermoleculares no propano e no metoximetano têm intensidades iguais.
A quantidade de energia necessária para ebulir 1,0mol de etanol é menor do que a quantidade de energia para fazer ebulir 1,0mol de butano, nas mesmas condições.
A −10ºC, a intensidade das forças de interações intermoleculares no butano são maiores que no propano.